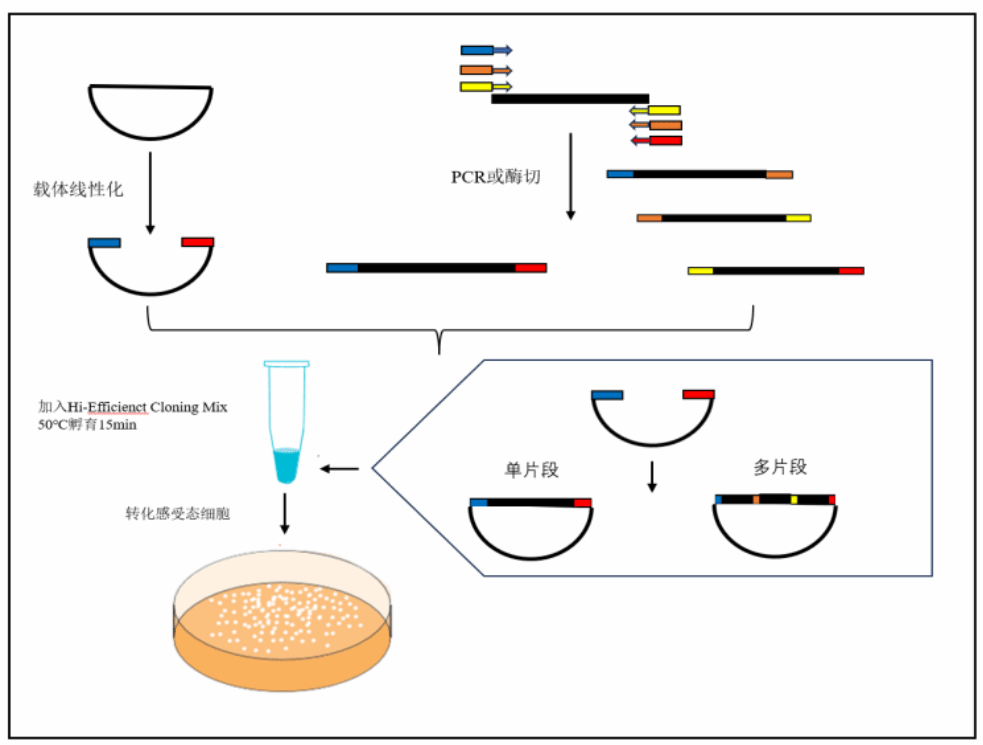
产品描述
Product overview 基于重组原理的无缝克隆技术,作为新一代的克隆方法,不依赖繁琐的酶切、连接步骤,也不需要末端 补平等操作,依据 DNA 片段与线性化载体末端的 15~25 nt 同源序列的重组,可将插入片段克隆至任意线性 载体的任意位点,载体自连背景极低,是一种简单、快速、高效的 DNA 定向克隆技术。 Hi-Efficienct Cloning Mix 为 2×重组 Mix,一次反应可完成单至多个 DNA 片段的重组, 仅需 5 分钟 即可完成单片段重组,且阳性率高于 95%。Cloning Mix 中添加的辅助因子,有效提高克隆阳性率,经优化的 反应体系,能够一定程度上耐受未纯化 PCR 产物中含有的杂质,在克隆阳性率与兼容性方面有着优异的表现。
运输与保存方法 Transportation and preservation methods
冰袋运输;-20℃保存,有效期 2 年;建议 次使用时分装冻存,避免反复冻融。
使用方法 Usage method
1. 克隆载体的线性化
选择合适的克隆位点,对载体进行线性化,载体的线性化可以通过酶切或反向PCR扩增完成。
1)酶切制备
使用限制性内切酶进行载体线性化时,推荐使用双酶切方法进行,其次是单酶切。推荐使用快速内切酶, 使载体线性化完全,可以适当延长酶切时间减少环状质粒模板残留,以降低转化背景(假阳性克隆)。
注 1:经双酶切进行线性化的载体无需去磷酸化,经单酶切则需要去磷酸化;
注 2:酶切完成后,应将快速内切酶失活或将目的产物进行纯化后再用于重组反应。
2)反向PCR扩增制备线性化载体:
反向 PCR 扩增制备线性化载体时为了减少扩增突变的引入,推荐使用高保真 PCR Mix 进行扩增,推荐 使用预线性化的质粒作为模板,以减少环状质粒模板残留对克隆阳性率的影响。
注:以环状质粒为模板时,PCR 产物需要使用 DpnI 等甲基化敏感型限制性内切酶对扩增产物进行处理,或对产物进行胶回 收纯化。
2. 目的片段的获取
1)目的片段 PCR 引物设计
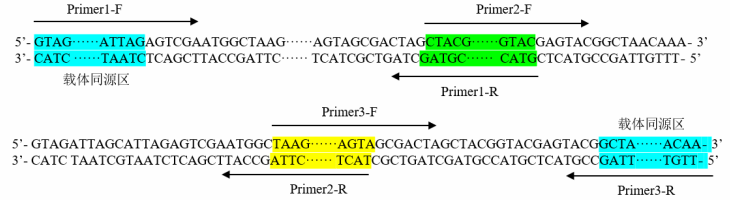
通常使用 PCR 扩增的方法来获得目的片段,PCR 引物的 5'端必须包含与其相邻片段(插入片段或载体) 末端同源的 15~25 nt(推荐 18 nt)序列,以保证扩增产物的 5'端和 3'端分别与相邻片段形成重叠序列。目的片 段 PCR 引物包括:载体与插入片段连接处引物、插入片段与片段连接处引物。 所得线性载体的两端因线性方式(双酶切、单酶切、反向 PCR 扩增等)不同,分为三种末端结构的任意 组合,插入片段的特异性引物的设计仍然遵循通常引物设计的原则。
方案一:克隆载体使用单酶切或者双酶切
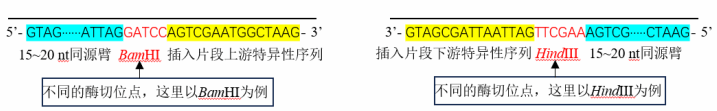
方案二:克隆载体使用反向 PCR 扩增

方案三:多片段引物设计方案
注 1:尽量选择无重复序列且 GC 含量均匀的区域进行克隆,当载体克隆位点上下游 25 nt 区域内 GC 含量为 40%~60%时, 重组效率 ;
注 2:最终的 PCR 引物长度如果超过 40 nt,推荐在引物合成时选用 PAGE 纯化。
2)目的片段的 PCR 扩增
推荐使用高保真 PCR Mix 进行插入片段的扩增,以减少突变的引入。
注:PCR 产物建议纯化后再进行重组反应;若 PCR 产物经琼脂糖凝胶电泳鉴定为特异性扩增产物,可以直接使用,但加样 体积不应超过 2 μl(总反应体积的 20%)。
实验流程